GMP Systemvalidierung in SAP
Gute Herstellpraxis für Arzneimittel und Wirkstoffe effizient in SAP umgesetzt!
Die SERKEM-Lösung im Detail
GMP Systemvalidierung in SAP
Die GMP (eng. Good Manufacturing Practice) oder auch „Gute Herstellpraxis“, beschreibt eine Form der Gewährleistung, dass Arzneimittel und Wirkstoffe dem höchsten Grad an Qualitätsanforderungen entsprechen und ein gerichtetes Qualitätsmanagement verfolgt wird. Hierbei wird zwischen GMP und cGMP unterschieden. GMP sind die Qualitätsanforderungen in Deutschland, wobei cGMP das Äquivalent in den USA darstellt.
Um die GMP-Vorgaben einhalten zu können, muss Ihr SAP-System über ein umfassendes Qualitätssicherungssystem verfügen. Außerdem sollte es vollständig dokumentiert und überwacht sein.
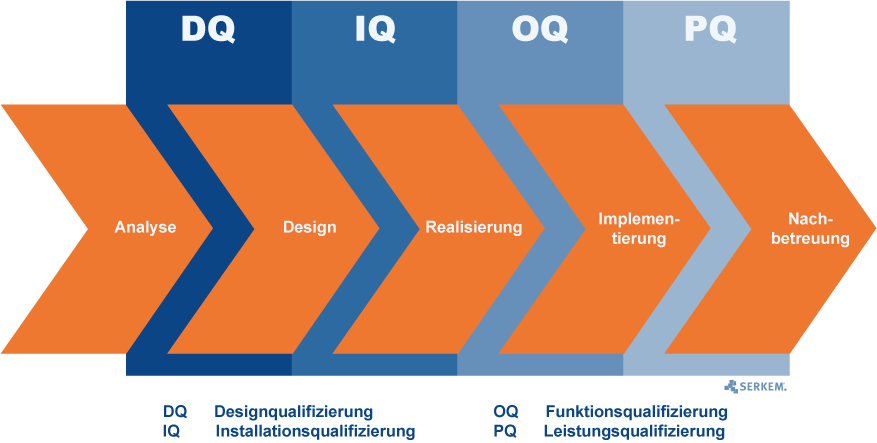
Zunächst ist zwischen Qualifizierung und Validierung zu unterscheiden:
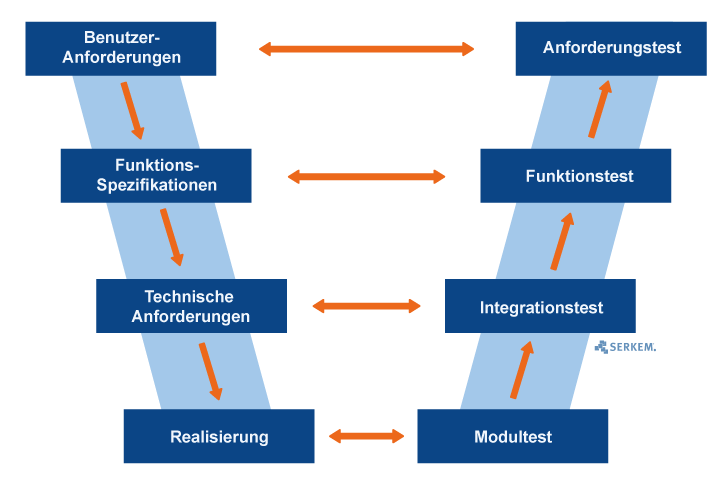
V-Modell zur Qualitätssicherung
Zur Validierung computergestützter Systeme wird häufig ein sogenanntes V-Modell als Referenzmodell verwendet. Der Vorteil dabei ist, dass diese Art von Modell in vielen verschiedenen Ausprägungen dargestellt und verwendet werden kann. Jedoch kann dies auch zu teilweise unübersichtlichen und missverständlichen Darstellungen führen.
Das V-Modell erhält seinen Namen durch die charakteristische Darstellung des Buschstabens „V“. Dabei bildet die linke Achse die verschiedenen Spezifikationsphasen und die rechte Achse die jeweiligen Testphasen.
Somit eignet sich das V-Modell sehr gut zur Darstellung von Spezifikations- und den dazugehörigen Testphasen und zur entsprechenden Anpassung an zuvor angefertigte Vorgabedokumente, Benutzeranforderungen und Systemspezifikationen.
Phasen des V-Modells
Hat man diese Phasen abgeschlossen und eine erste Validierung durchgeführt, so folgt die Realisierung. Je nach Vorgehensweise werden dann erst die entsprechenden Tests durchgeführt. Somit findet das V-Modell im speziellen Bezug auf GMP vor allem in den beiden Implementierungsschritten DQ und IQ Anwendung.
Sollten Sie Unterstützung bei der Validierung Ihres SAP-Systems benötigen können Sie uns gerne kontaktieren.